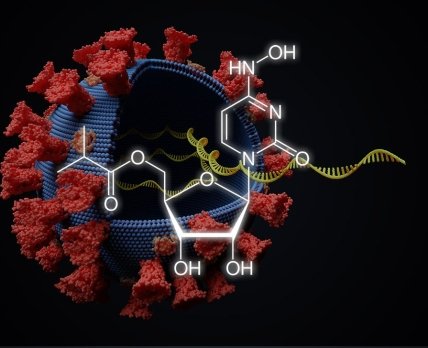
Merck починає процес реєстрації свого противірусного препарату для терапії COVID-19 в Канаді.
Міністерство охорони здоровʼя Канади приступило до розгляду реєстраційного досьє молнупіравіра — перорального противірусного препарата для лікування COVID-19 від Merck & Co і Ridgeback Biotherapeutics.
Результати випробувань фази 2/3, включаючи ранні дані про безпеку, якість та ефективність препарату Merck, будуть розглянуті регулятором, поки ще тривають дослідження третьої фази, зокрема масштабне випробування MOVe-OUT. Кандидат Merck & Co зараз оцінюється і в інших проектах, наприклад, тільки в Україні запущено чотири випробування по оцінці цього кандидата, три з них — на етапі набору учасників.
Проміжні результати фази 2/3 які показали, що препарат сприяє скороченню часу елімінації SARS-CoV-2 з мазків у пацієнтів з симптоматичним COVID-19. До пʼятого дня ні у одного з пацієнтів, які отримували молнупіравір, не було ознак вірусу, в порівнянні з 24% пацієнтів, які отримували плацебо.
Merck & Co і Ridgeback Biotherapeutics покладають великі надії на молнупіравір, який, як і Veklury (ремдесівір) виробництва Gilead, належить до класу інгібіторів полімерази, що блокують реплікацію вірусу SARS-CoV-2. У лабораторних дослідженнях було показано, що він може націлюватися і на інші респіраторні віруси, такі як збудники грипу і лихоманки Ебола.
Уряд Сполучених Штатів уже замовив у Merck 1,7 мільйона курсів цього препарату, хоча він ще не схвалений FDA.






