- Категория
- Новости
FDA одобрило комбинированный препарат Johnson & Johnson для контроля легочно-артериальной гипертензии
- Дата публикации
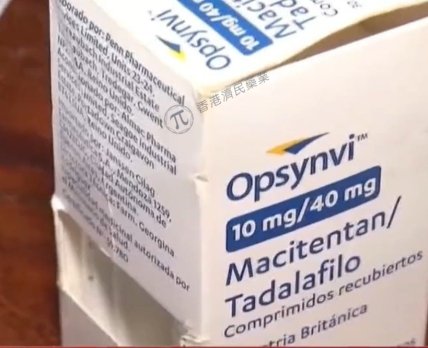
Американский регулятор вынес положительное решение относительно нового препарата для лечения легочно-артериальной гипертензии (ЛАГ).
ЛАГ – это редкое, быстро прогрессирующее заболевание, приводящее к сердечной недостаточности.
FDA зарегистрировало для лечения ЛАГ Opsynvi — таблетку, которая сочетает в себе два действующих вещества: антагонист рецепторов эндотелина Opsumit (мацитентан Johnson & Johnson) и обратный селективный ингибитор специфической ФДЕ-5 Adcirca (тадалафил United Therapeutics). Эти два средства обычно назначают вместе в терапии ЛАГ, а Opsynvi с режимом приема один раз в сутки сделает лечение более удобным.
Положительное решение FDA основывалось на результатах исследования A DUE, которые показали, что он значительно улучшает кровоток через легочные сосуды по сравнению с Opsumit или Adcirca (как монотерапия). Всего в исследовании участвовало 187 пациентов в 19 странах.
Новый препарат Johnson & Johnson смогут использовать пациенты с недавно установленным диагнозом, ранее не проходившие терапию, а также те, кто уже принимает Opsumit или Adcirca, отдельно или в комбинации.
По мнению производителя, Opsynvi «имеет потенциал для оптимизации лечения ЛАГ и удовлетворения в значительной степени неудовлетворенных потребностей в поддержке недавно обновленных клинических установок, требующих начального или раннего комбинированного лечения».
Между тем, американский регулятор должен вскоре одобрить сотатерцепт – препарат для лечения ЛАГ от Merck. Эксперты не ожидают, что эти продукты будут конкурировать, поскольку сотатерцепт подавался на регистрацию как средство дополнительной терапии к текущим методам лечения, таким как Opsumit и Adcirca.




