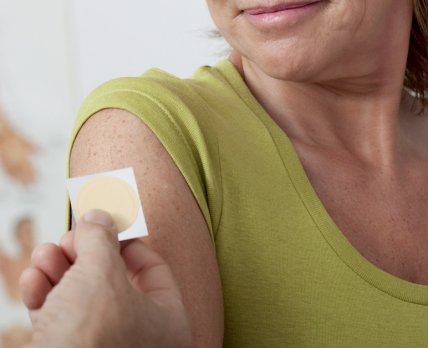
FDA отказалось утвердить пластырь от аллергии на арахис французской биотехнологической компании DBV Technologies.
Французская биотехнологическая компания DBV Technologies сообщила, что FDA отказалось утвердить ее пластырь от аллергии на арахис Viaskin Peanut из-за проблем с дизайном опорного исследования. Агентство указало, что сам продукт нуждается в модификациях, а его доказательная база – в большем количестве клинических данных, подтверждающих эффективность пластыря. На удовлетворение этих запросов могут уйти годы, которые еще больше изнурят компанию, и без того ограниченную в ресурсах.
Пластырь, разработанный DBV Technologies, доставляет небольшое количество арахисового антигена через кожу для постепенного снижения чувствительности к этому триггеру. Продукт крепится верхнюю часть спины и постепенно «выветривается» по мере продолжения десенсибилизирующего лечения.
По словам производителя, агентство не смогло утвердить десенсибилизирующий пластырь в его нынешней форме из-за опасений, что пластырь потеряет эффективность, если не будет прилипать к коже полностью. Кроме того, FDA потребовало провести еще одно исследование на тему «человеческого фактора», чтобы узнать, как именно пациенты используют пластырь. Также регулятор запросил дополнительные данные о производственных процессах Viaskin Peanut и результатах проведенных испытаний.
Собственно, отказ американского регулятора не стал неожиданностью, учитывая многочисленные трудности, с которыми столкнулась DBV Technologies при разработке и утверждении своего продукта. Например, он не достиг первичной конечной точки в масштабном клиническом исследовании 2017 года, имевшем решающее значение для демонстрации достоинств Viaskin Peanut. А в конце 2018 года компания добровольно отозвала регистрационную заявку на Viaskin Peanut после того, как FDA указало на отсутствие в досье важных данных о производстве и контроле качества.






